EGFR変異については、タンパク質構造に基づく分類(タンパク質構造にもとづくEGFR変異の新しい分類 - 精密医療電脳書)が重要になってくる、と思われます。そのためにEGFRのタンパク質構造と機能について説明します。さらに主要な変異、エクソン19欠失とL858Rの構造の特徴について説明します。
野生型EGFRのタンパク質構造
EGFRは、上皮成長因子(EGF)などのリガンドが結合すると、細胞の増殖や分化を促すシグナルを伝える受容体です。EGFRは、細胞外領域、細胞膜貫通領域、細胞内領域の3つの部分からなります。図1Aは、野生型EGFRの構造を簡単に示したものです。EGFRにリガンドが結合すると、EGFRは2つくっついて二量体になります。このとき、細胞内領域にあるチロシンキナーゼという酵素が活性化されます。チロシンキナーゼは、EGFRの細胞内領域にあるチロシンというアミノ酸にリン酸を付けます。これによって、細胞内の他のタンパク質が反応して、最終的には核で遺伝子の発現を変えるシグナルが伝わります。図1Bは、活性型チロシンキナーゼ領域の詳細な構造です。この領域は、N-lobeとC-lobeという2つの部分に分かれます。N-lobeは、リン酸を付ける対象となるATPという物質を結合する部分で、P-loopとαC helixという構造を持ちます。C-lobeは、触媒部位(catalytic loop)と活性化部位(A-loop)という構造を持ちます。

図1.野生型EGFRのタンパク質構造。A、EGFR全体の模式図。B、キナーゼ領域活性型の3次元構造。重要部位をオレンジで表示。ATPはスティックで表示。ボックス内はE762とK745間の塩橋。C、活性型及び非活性型キナーゼ領域中核部位の構造。活性型(青)と非活性型(赤)を重ね合わせて表示。登録の多いSrc-like 非活性型を表示している。
野生型EGFRの活性化状態と非活性化状態の比較
チロシンキナーゼ領域は、活性化状態と非活性化状態の2つの形を取ります。活性化状態では、αC helixがATP結合部位に近づき(”αC-in”)、E762とK745というアミノ酸同士が塩橋(salt bridge)という結合を作ります(図1B、ボックス)。これによって、チロシンキナーゼが安定してATPにリン酸を付けられるようになります。またA-loopは伸びた状態(”DFG-in”)になります。DFG-motifというアミノ酸の並びがA-loopの先端にあります。
図1Cは活性化状態と非活性化状態のEGFRをかさねあわせたものです。非活性化状態では、αC helixがATP結合部位から離れ(”αC-out”)、E762とK745間の塩橋が消えます。また、A-loopのN端がコイル状になります。これらの変化により、チロシンキナーゼが不安定になり、ATPにリン酸を付けられなくなります。図2は、これらの構造をアミノ酸配列上に示したものです(構造分類のページの図とおなじものです)。

図2.EGFR二次構造と構造にもとづく分類。青。アルファヘリックス、波線;ベータシート、緑矢印;エクソンの境界、縦細線。古典的変異、紫;PACC、黄;Ex20ins-L、茶;T790M様変異、なお、T790M-likeの複合変異は表示していない。
EGFR主要変異のキナーゼ活性化メカニズム
EGFRに変異が起こると、チロシンキナーゼ領域の形や働きが変わってしまいます。肺がんではエクソン19欠失変異やL858R変異がよく見られます。耐性変異であるT790Mを加え、これらの変異の位置を図3で示しました。
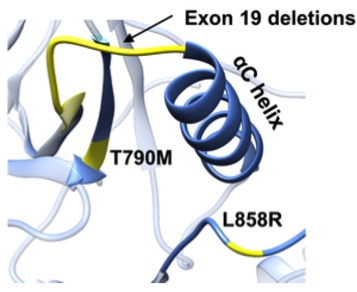
図3.EGFR主要変異。図2ではアミノ酸配列上の位置がわかる。
エクソン19欠失
エクソン19欠失変異では、N-lobeの一部分、N-lobeの3番目のβ構造(β3 strand)とαC helixの間のアミノ酸配列の欠失です(図2、3)。これによって、αC helixが安定化し、塩橋の結合も強くなります。さらに、ATPとの水素結合も増えます。これらの変化で、チロシンキナーゼが常に活性化されるようになります。
L858R
L858はA-loopのN端にあるDFG motifに隣接しており、野生型ではF723, L747, M766, L788とともに疎水性アミノ酸クラスターをつくってDFG motifのコイル構造(非活性型の特徴)を安定化しています。L858Rでは、この疎水性クラスターが壊れるため、コイル構造が不安定化する、という特徴があります。とくに、F723の側鎖の方向が変わってR748と相互作用するため、活性部位の溝が広がります。その結果ATPの遊離速度が上昇し、EGFR-TKIとの親和性が野生型の10から100倍に上昇します。
参考文献
Tamirat, M.Z. et al., PLoS ONE 2019 14(9): e0222814. DOI:10.1371/journal.pone.0222814
Vilacha, J.F. et al. Crystals 2020 10: 725. DOI:10.3390/cryst10090725